基礎講座|pH中和処理制御技術 2-1. pHとは? 水の電離・水のイオン積
水の電離
水は共有結合の化合物です。
共有結合の化合物はイオン結合の化合物と異なり、イオンにはなりません。
しかし、水の場合は例外的にごくわずかですが水素イオンH+と水酸イオンOH-とに電離しています。(それは純粋な水の電気伝導度を測定することにより知ることができます。)
H2O ⇔ H+ + OH-
(水) (水素イオン)(水酸イオン)
実際には、次の図に示すように水素イオンはヒドロニウムイオンH3O+になっていますが、水素イオンとした方が簡単でわかりやすいので以後この式によって話を進めていきます。
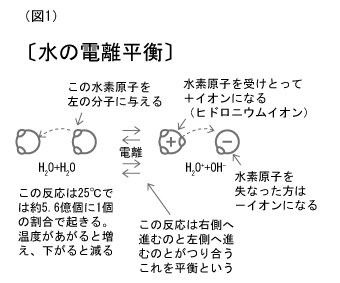
この反応式にはお互いに逆方向を向いた矢印が2本書いでありますが、これは右辺へ進む反応と左辺へ進む反応が、ちょうど釣り合っていることを示しています。
この釣り合っている状態を化学用語では、「平衡」といいます。
純粋な水の電離によって生ずる水素イオンの濃度〔H+〕と水酸イオンの濃度〔OH-〕は等しく、精密な測定結果によれば、25℃でそれぞれ 1.0×10-7 (mol/L) であることが知られています。
〔H+〕=〔OH-〕=1.0×10-7 (mol/L)
※1リットル中に10-7モルしか含まれていないので、その濃度は極めて薄いといわなければなりません。
mol/Lという記号ーはモル・パー・リッターと読み、水溶液1リットル中に何モルの物質が溶けているかを示しています。〔H+〕の記号は水1リットル中に含まれている水素イオンのモル濃度、すなわちmol/Lを表わします。
水のイオン積
水中における水素イオンの濃度と水酸イオンの濃度との積(掛け合わせたもの)は、特定の温度では特定の値を示し、温度を変えるとその値も変化します。
25℃では水素イオン濃度と水酸イオン濃度の積は、次のようになります。
水のイオン積Kw = 〔H+〕 × 〔OH-〕
(at25℃) = 〔1.0 × 10-7〕 × 〔1.0 × 10-7〕
= 1.0 × 10-14 (mol/L)2
⇒ 一定
イオンのモル濃度の積が一定であるということは、一方のイオン濃度をあげると他方のイオン濃度は低下するということです。


