基礎講座|pH中和処理制御技術 6-1. pH制御に必要な中和剤の理論必要量
pH値を目標値にするのに必要な中和剤の量を求める方法を考えてみましょう。
なお、この項目で考える中和反応は、強酸と強アルカリ、あるいは弱酸と強アルカリとの反応の場合は、加水分解反応(「2-5. pHとは? 加水分解とは・塩の水溶液の性質」をご参照ください。)が生じるために、計算方法が異なります。
中和剤の理論必要量
廃水の中和およびpH調整で、処理目標pH値にする場合の中和剤の理論必要量は次式で表されます。
Z(mL/min)=(N × n × Q × 105) / (60 × W × D) (1)
- Z:
中和剤必要量(mL/min)
- N:
中和剤の1グラム当量(g)
- n:
必要な[H+]あるいは[OH-]濃度(mol/L)
- Q:
原水流量(m3/Hr)
- W:
中和剤の濃度(wt%)
- D:
中和剤の比重
- 105、60:
単位換算係数
参考:式(1)の導き方
水溶液のpHは、[H+]や[OH-]が増減することによって変わります。
つまり、酸やアルカリを添加して[H+]や[OH-]を増やせば良いのです。
あるpH値にするために必要な[H+]あるいは[OH-]の必要量をa(mol)とします。
H+をa mol増やすには、HCLはa mol(36.5 × a(g))、H2SO4はa / 2mol(49 × a(g))、H3PO4はa / 3mol(32.7 × a(g))というように、1グラム当量N × a(g)の中和剤が必要です。(OH-の場合も同様)
ここで濃度W(wt%)の薬液A(g)に含まれる中和剤N × a(g)を表すと
N × a(g) = A(g) × (W / 100)
式を整理すると
A(g) = (N × a × 100) / W
1L当たりとするために、a molを n mol/Lに変換して
B(g/L) = (N × n × 100) / W
重量単位のため、比重(≒密度)D(g/mL)で割って容積に換算すると
C(mL/L) = B(g/L) / D(g/mL) = (N × n × 100) / (W × D)
次に、原水流量をQ(m3/Hr)、つまりQ × 1000(L/Hr)とすると
E(mL/Hr) = C(mL/L) × Q × 1000(L/Hr) = (N × n × Q × 105) / (W × D)
最後にHrをminに換算すると、
Z(mL/min) = E(mL/Hr) / 60 = (N × n × Q × 105) / (60 × W × D)
になり、式(1)が導けます。
ここで、式(1)のnが各種条件下で異なってくるわけですが、
- 原水pH値=GpH
- 処理目標pH値=SpH
とすると、以下のように分類できます。
Gph>SpH(原水pH値が目標pH値より高い場合)
原水に酸の薬液を添加します。
| 条件 | n:必要な[H+]濃度(mol/L) | |
|---|---|---|
| A | GpH≧7 SpH≧7 |
{10-(14-GpH)-10-(14-SpH)} |
| B | GpH≧7 SpH<7 |
{10-(14-GpH)+10-SpH-2・10-7} |
| C | GpH<7 SpH<7 |
(10-SpH-10-GpH) |
GpH<SpH(原水pH値が目標pH値より低い場合)
原水にアルカリの薬液を添加します。
| 条件 | n:必要な[OH-]濃度(mol/L) | |
|---|---|---|
| D | GpH≧7 SpH≧7 |
{10-(14-SpH)-10-(14-GpH)} |
| E | GpH<7 SpH≧7 |
{10-(14-SpH)+10-GpH-2・10-7} |
| F | GpH<7 SpH<7 |
(10-GpH-10-SpH) |
従ってA~Fの諸条件でのnを式(1)に代入すると以下のようになります。

これらの式に諸項目を代入すれば、理論注入量がもとめられます。
次表にN(1グラム当量)の値を代表的な中和剤について示します。
| 薬液名 | 1グラム式量(g) | 1グラム当量(g) |
|---|---|---|
| HCL | 36.5 | 36.5 |
| H2SO4 | 98.0 | 49.0 |
| NaOH | 40.0 | 40.0 |
塩酸、水酸化ナトリウムはそれぞれ一塩基酸、一酸塩基ですので1グラム式量と同じ値です。また、硫酸のような二塩基酸は1グラム式量を2で割った値が1グラム当量になります。
つまり、GpH>SpHならば塩酸または硫酸の1グラム当量を(2)~(4)式へ、GpH<SpHならば水酸化ナトリウムの1グラム当量を(5)~(7)に代入すれば良いことになります。
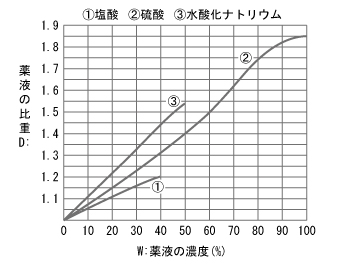
比重について
グラフの値を直接読み取るか、次の概算式に濃度を代入して求めます。
〔D:比重、W:濃度(%)〕
(1)塩酸の場合 0 ≦ W ≦35 ・・・D=1 + 5.125 × 10-3 × W
(2)硫酸の場合 0 ≦ W ≦35 ・・・D=1 + 7.14 × 10-3 × W
35<W ≦90 ・・・D=1 + 0.01 × W
90<W ・・・D=1.84
(3)水酸化ナトリウムの場合 D=1 + 1.07 × 10-2× W