基礎講座|滅菌・殺菌 12-3. 次亜塩素酸ナトリウムについて
安全で効果的な殺菌システムを設計するには、使用する薬剤の性質を正しく知ることが大切です。ここでは現在もっとも多くの現場で使用されている次亜塩素酸ナトリウムについて見てみましょう。
名称
| 化学名 | 次亜塩素酸ナトリウム(Sodium hypochloride) |
|---|---|
| 構造式 | NaClO |
| 分子量 | 74.5 |
| 官報公示整理番号 | 化審法 (1)-237 |
製造方法
次亜塩素酸ナトリウムは、一般に水酸化ナトリウム水溶液に塩素ガスを吸収させて製造します。
2NaOH + Cl2 → NaClO + NaCl + H2O ・・・ (1)
2NaOH:水酸化ナトリウム、Cl2:塩素、NaClO:次亜塩素酸ナトリウム、NaCl:食塩、H2O:水
- ※ 次亜塩素酸ナトリウムの種類は製法によって次の二種類があります。
- 工業用
連続発熱反応方式とよばれる方法(1)で製造されます。発熱反応のため塩素の吸収が不十分で不純物の化合もあり安定性に欠けます。 - 医薬用、食品添加物、合成殺菌料
冷却連続反応方式で製造されます。(1)の方法で濃度の高い次亜塩素酸ナトリウムをつくったのち、これを冷却して析出した塩化ナトリウム(食塩)を除去したもので、一般に低食塩次亜とよばれ、純度が高く安定しています。 - 規格
一般に市販されているものは有効塩素が4~12%の水溶液であり、品位(JIS規格等)は特に規定されていません。次亜塩素酸ナトリウムとして食品添加物公定書に規格があるだけです。例)
有効塩素 12%以上 4.0~6.0% pH 12.5以上 12.0以上 鉄(Feとして) 0.003%以下 外観 淡緑黄色の液体で透明なこと - ※ 家庭用、食品添加物用として
- ※
次亜塩素酸ナトリウムの有効塩素とは
NaClOの分解により生成する2価の酸素原子の酸化力が1価の塩素の2原子当量に相当するので、NaClOの結合塩素1原子は非結合塩素(Cl2)の2原子と同じ酸化力を有することになります。このことはNaClOと共存する酢酸溶液中でヨウ化カリウムからヨウ素の遊離を示す次式からも明らかです。
NaClO + 2KI + 2CH3COOH = I2 + NaCl + 2CH3COOK + H2O ・・・(2)
一方、非結合塩素であるCl2では
Cl2 + 2KI = I2 + 2KCl ・・・(3)
となりますので、上記のことが確認できます。
従って、有効塩素 = 2 ×(NaClO中の塩素)となります。
物理的性質
- 外観
淡緑黄色で透明な液体です。また空気、熱、光などに対してきわめて不安定で、放置すると徐々に有効塩素を失います。 - 臭気
塩素に似た特有の強い臭いがあります。 - 比重
比重と有効塩素との関係を表1に示します。
表1 次亜塩素酸ナトリウム水溶液の比重と有効塩素比重
(20℃)有効塩素濃度
(g/L)次亜塩素酸ナトリウム
(wt.%)1.05 30 3.00 1.07 40 3.94 1.08 50 4.87 1.09 60 5.76 1.11 70 6.64 1.12 80 7.50 1.13 90 8.34 1.15 100 9.16 比重
(20℃)有効塩素濃度
(g/L)次亜塩素酸ナトリウム
(wt.%)1.16 110 10.05 1.17 120 10.76 1.18 130 11.53 1.20 140 12.28 1.21 150 13.03 1.22 160 13.75 1.24 170 14.45 1.24 178 15.00 - ※ 市販の次亜塩素酸ナトリウムの比重は約1.20です。
- ※
化学的性質
- 自然分解
次亜塩素酸ナトリウムは常温でも不安定な化合物で、その水溶液も保存中に自然分解し酸素を放出します。NaClO→ NaCl +(O)・・・(4)
この酸素(発生期の酸素)は強力な酸化作用を示します。またこの際、副反応として塩素酸ナトリウムを生成します。
2NaClO→ NaCl + NaO2Cl ・・・(5)
NaO2Cl + NaClO→ NaCl + NaO3Cl ・・・(6)
(5)(6)の反応は40℃以上で急激に進みます。またpHが低いほど速くなり、反応を抑制するにはpH11以上が必要です。
- 光化学分解
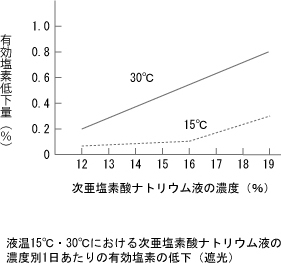
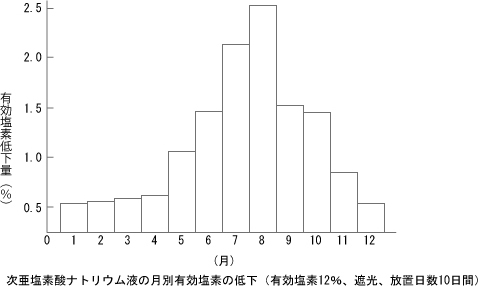
日光、特に紫外線により分解が促進されます。日光に約20時間さらされた場合は、90%の有効塩素が分解します。 - 加熱分解
温度の上昇とともに分解率が増加します。特に夏期は注意が必要であり、直射日光下に置かないことが重要です。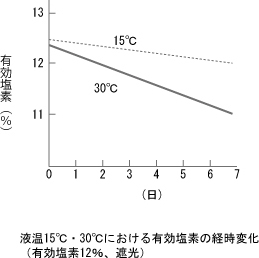
- 酸による分解
次亜塩素酸ナトリウムはpHの低下とともに分解が促進されます。pH5以下で塩素ガスが発生しはじめ、pH3以下で急激に分解します。特に、酸の混入にはご注意ください。 - 重金属類による触媒的分解
次亜塩素酸ナトリウム液中にFe、Co、Ni、Mn、Cuなどの重金属およびその塩類が存在すると著しく分解が促進されます。 - 爆発性および引火性
一般に市販されている次亜塩素酸ナトリウム水溶液は、爆発および引火の危険性はありません。 - 腐食性
酸化性が強く、ほとんどの金属類、天然繊維類を腐食させます。 - 用途
水道水やプール水の殺菌、脱臭、脱色、酸化処理、シアン廃水等の分解処理、除鉄・除マンガン、食品添加剤としてなど、強い酸化力を利用した多くの用途があります。
出典:日本ソーダ工業会発行『安全な次亜塩素酸ソーダの取扱い』


